Schiffman, S.S. et al (2023)
Is sucralose (en sucralose-6-acetaat) schadelijk voor het DNA en de darmen?
Journal of Toxicology and Environmental Health B Crit Rev. 2023;1-35.
Soort onderzoek: in vitro
Amerikaanse onderzoekers van de North Carolina State University hebben resultaten gepubliceerd van hun nieuwe studie [1]. Die studie bestond uit een achttal laboratoriumexperimenten (in vitro) waarin ze cellen hebben blootgesteld aan sucralose en sucralose-6-acetaat (S6A). Uit deze resultaten blijkt dat sucralose en S6A het DNA beschadigen. Dat zou het risico op kanker kunnen verhogen, hoewel dat niet is onderzocht. Daarnaast is gevonden dat sucralose en S6A de doorlaatbaarheid van de dikke darmwand laten toenemen. Heeft deze studie gevolgen voor het gebruik van sucralose?
Studie
Schiffman SS, Scholl EH, Furey TS, Nagle H. Toxicological and pharmacokinetic properties of sucralose-6-acetate and its parent sucralose: in vitro screening assays [published online ahead of print, 2023 May 29]. J Toxicol Environ Health B Crit Rev. 2023;1-35.
Wat is de aanleiding en hoofdvraag van de onderzoekers?
Sucralose is een zoetstof die ongeveer 600 keer zoeter is dan suiker. Het wordt in verschillende stappen gemaakt uit sacharose (tafelsuiker). Bij één zo’n stap ontstaat sucralose-6-acetaat (S6A) dat verder wordt bewerkt. Een klein deel daarvan is echter nog terug te vinden in sucralose als eindproduct.Voor de goedkeuring van sucralose als zoetstof in Amerika, Europa en Azië is er gekeken naar [1-5]:
- Stabiliteit in het lichaam: sucralose passeert onverandert de darmen.
- Darmmicrobiota: sucralose heeft geen effect op de darmmicrobiota.
- Darmbarrière: sucralose heeft geen effect op darmweefsel.
- Ophoping: sucralose hoopt zicht niet op in het lichaam.
- Metabolisme: sucralose heeft geen effect op de bloeduiker- en insulinespiegel.
- Biogische en toxiche impact: sucralose is hittestabiel, niet schadelijk voor het DNA (genotoxisch) en is niet geassocieerd met biologische consequenties.
Onderzoeker Susan Schiffman en haar collega’s van de North Carolina State University (NCSU) zijn echter van mening dat recentere studies geen van de bovenstaande eigenschappen bevestigen. Daarnaast is onduidelijk of de ongewenste effecten veroorzaakt worden door sucralose, het tussenproduct S6A of beide. Directe blootstelling aan S6A is mogelijk door inname van sucralose, of indirect door de afbraak van sucralose in de darmen waarbij S6A gevormd wordt.
Commerciële producten met sucralose bevatten tot 0,67% S6A [6]. In de ontlasting van ratten worden echter percentages tot 10% gevonden [6, 7]. Dit verschil wordt waarschijnlijk veroorzaakt doordat bacteriën in de darmen de sucralose afbreken waarbij S6A ontstaat.
Nieuwe studies zouden de veiligheid van sucralose niet bevestigen en er is weinig bekend over de veiligheid van S6A. Om daar meer duidelijkheid over te krijgen hebben onderzoekers een achttal experimenten gedaan met zowel sucralose als S6A.
Genotoxisch versus mutageen Wanneer iets genotoxisch is, veroorzaakt het veranderingen aan het genetisch materiaal (DNA). Gebeurt dit in een kiemcel dan worden die veranderingen doorgegeven aan het nageslacht. Vindt de verandering in andere cellen plaats (somatische cellen) dan kan dit leiden tot kanker, maar hoeft niet. Het lichaam heeft namelijk verschillende mechanismen om die veranderingen te herstellen. Mutageen is altijd genotoxisch, maar genotoxisch is niet altijd mutageen. |
Welke onderzoeksmethode is gebruikt?
De onderzoekers hebben een achttal complexe laboratorium-experimenten (in vitro) uitgevoerd. In die experimenten hebben ze voornamelijk menselijke bloed of darmwandcellen blootgesteld aan sucralose (met 0,5% S6A) en S6A. Bij sucralose hebben ze dat, afhankelijk van het experiment, op twee manieren gedaan, namelijk door wel of geen enzymen toe te voegen die de afbraak van sucralose in de darm te simuleren (wel of geen activiatie). Het gaat om de volgende acht experimenten:
Experiment 1
Een in vitro MultiFlow®-test in menselijke bloedcellen (lymfoblasten) waarin naar merkers voor genotoxiciteit is gekeken.
Experiment 2
Een traditionele in vitro-test in menselijke bloedcellen (lymfoblasten) om mogelijke cytogenetische/chromosomale schade te beoordelen.
Experiment 3
Het Leadscope®-programma om chemische kenmerken te voorspellen die blijvende DNA-schade veroorzaken die overerfbaar zijn (mutageen).
Experiment 4
Een traditionele in vitro-test (de Ames-test) om het mutagene effect te beoordelen. Hiervoor zijn bacteriën gebruikt (Salmonella typhimurium en Escherichia coli) die door een mutatie geen histidine kunnen aanmaken en daardoor afhankelijk zijn van histidine in de voedingsbodem waarop ze groeien. Wanneer deze bacteriën na blootstelling aan sucralose of S6A op een histidine-arme voedingsbodem wel kunnen groeien hebben er terugmutaties plaatsgevonden en is de stof mutageen.
Experiment 5
Het RepliGut®-systeem om op indirecte wijze de mogelijke aantasting en doorlaatbaarheid van de epitheelcellen van de darmwand te beoordelen. Hier hebben ze de elektrische weerstand over gekweekte darmwandcellen gemeten met ‘Trans Epithelial Electrical Resistance’ (TEER), wat een marker is voor de darmdoorlaatbaarheid.
Experiment 6
RNA-sequencing van darmwandcellen om de genexpressie (het tot uiting brengen van een gen) te beoordelen.
Experiment 7
Een microsoomstabiliteitstest van levercellen om bepaalde metaboliseringsprocessen te onderzoeken. Daarvoor hebben ze vijf verschillende soorten cellen gebruikt (mens, aap, hond, rat en muis).
Experiment 8
Een test waarin werd gekeken naar het effect op ontgiftingsprocessen van een enzymcomplex (cytochroom P450). De volgende medicijnen zijn daarvoor gebruikt: fenacetine (pijnstiller), diclofenac (NSAID), fenytoïne (anti-epilectica), dextromethorfan (dempt hoesprikkel), midazolam (benzodiazepine). Een remming van dat enzymcomplex zou tot interacties met medicijnen kunnen leiden.
Wat is de bewijskracht van de gekozen onderzoeksmethode?
Alle experimenten waren in vitro-studies. Dat zijn studies die buiten het lichaam, in geïsoleerde cellen, weefsels of organen plaatsvinden (bijvoorbeeld in reageerbuisjes). In dit geval menselijke cellen en bacteriën. Dergelijk studies hebben een lage bewijskracht.
Er bestaat een piramide van bewijskracht waarin dit visueel duidelijk wordt gemaakt (zie figuur 1). Wat in cellen wordt gevonden, hoeft niet in levende organismen zoals de mens te gebeuren. Het menselijke lichaam is veel complexer dan enkele cellen. Dat betekent niet dat in vitro-studies zinloos zijn. Ze kunnen wel gebruikt worden om gegevens te verkrijgen die nodig zijn voor vervolgonderzoek, bijvoorbeeld in proefdieren (in vivo). Ze kunnen dus wel een plaats hebben in een onderzoekstraject, maar niet om er al eindconclusies op te baseren.
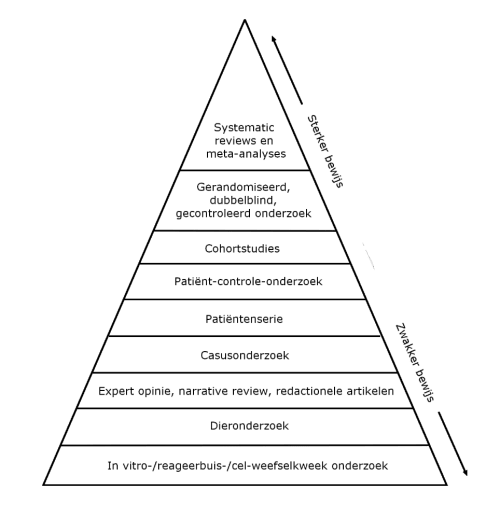
Figuur 1: Piramide van bewijskracht. Naarmate een studie-opzet hoger in de piramide staat neemt de bewijskracht toe. In vitro-studies staan onderaan in de piramide.
Welke resultaten zijn er gevonden?
Experiment 1
- S6A liet zowel geactiveerd als niet geactiveerd een genotoxisch effect zien vanaf 353 μg/ml.
- Sucralose liet zowel geactiveerd als niet geactiveerd geen genoxisch effect zien.
Experiment 2
- S6A liet zowel geactiveerd als niet geactiveerd een toename zien van een marker voor cytogenetische/chromosomale schade.
- Voor sucralose is deze test niet gedaan omdat een test voor de beoordeling van sucralose als veilige zoetstof niet eenduidig was en de MultiFlow®-test (experiment 1) negatief was.
Experiment 3
- Het Leadscope®-programma voorspelde dat S6A mutageen kan zijn. Voor sucralose waren de resultaten niet eenduidig.
Experiment 4
- Zowel S6A als sucralose waren niet mutageen. Dit is tegenstrijdig met de voorspelling uit het Leadscope®-programma. Deze resultaten suggereren dat hoewel eerdere testen lieten zien dat S6A genotoxisch is, de veranderingen niet blijvend (mutageen) zijn.
Experiment 5
- Zowel S6A als sucralose verhoogden de doorlaatbaarheid van de darmwand. Bij 24 uur blootstelling aan S6A werd vanaf een concentratie van 5 mM een afname van TEER gezien Bij sucralose was dat vanaf 40 mM. Afhankelijk van het voedingsmiddel mag er niet meer dan 3.000 mg sucralose per kilogram in zitten (6 mM), en meestal is dat veel minder [8]. In niet-alcoholische dranken is dat bijvoorbeeld 300 mg/liter. Een concentratie van 40 mM in de darm zal daarom niet (snel) gehaald worden, hoewel ook rekening gehouden moet worden met S6A dat in de darmen bij de afbraak van sucralose wordt gevormd en de concentratie zal verhogen.
Experiment 6
- S6A veranderde vergeleken met controle de expressie van 34 genen die betrokken zijn bij onder andere ontstekingen, oxidatieve stress en kanker.
- Sucralose veranderde vergeleken met controle de expressie van slechts twee genen (COX10, FAM166A) waarvan de betekenis onduidelijk is.
Experiment 7
- De metaboliseringsprocessen zijn onderzocht, inclusief de fractie S6A dat door de lever verwijderd wordt. Een betekenis daaraan wordt niet gegeven. De halfwaardetijd van S6A is 37,6 minuten en van sucralose >180 minuten.
Experiment 8
- S6A werkte bepaalde enzymen binnen het cytochroom P450-complex tegen.
- Sucralose werkte geen enzymen binnen het cytochroom P450-complex tegen.
Wat zijn de conclusies van de onderzoekers?
De auteurs concluderen dat de gevonden resultaten aanleiding geven tot bezorgdheid over de veiligheid van sucralose. Tevens geven ze aan dat de wettelijke status van sucralose als veilige zoetstof moet worden herbeoordeeld.
Wat zijn de sterke punten van de studie?
- Er is niet alleen naar sucralose gekeken, maar ook naar S6A waar weinig over bekend is.
- Er is naar verschillende eigenschappen van zowel sucralose als S6A gekeken.
Wat zijn de zwakke punten van de studie?
- Alle experimenten waren in vitro-experimenten. Die hebben een lage bewijskracht omdat ze niet naar mensen toe te vertalen zijn. Dat komt omdat de cellen aan verschillende concentraties sucralose en S6A zijn blootgesteld (xx μg/ml). Die concentraties kunnen echter niet vertaald worden naar een bepaald innameniveau van sucralose (xx mg/kg lichaamsgewicht). Het is niet zo dat bekend is aan welke concentratie de verschillende cellen worden blootgesteld na inname van bijvoorbeeld 50 mg sucralose. Onduidelijk is dan ook hoe hoog de inname van sucralose moet zijn voordat de gevonden effecten in het menselijk lichaam zouden optreden en hoe groot het risico dan is.
- Er worden soms tegenstrijdige resultaten gevonden. Zowel binnen deze experimenten als wat andere studies hebben laten zien.
Wat laten andere studies zien?
Sucralose en genotoxiciteit/kanker
Na de Europese en Amerikaanse rapporten waarin sucralose als veilig zoetmiddel is beoordeeld, zijn er verschillende overzichtsartikelen verschenen. Daarin is naar de meest recente wetenschappelijke literatuur gekeken wat betreft het genotoxische en carcinogene effect van sucralose.
De Sofritti-studie uit 2016 In 2016 is er door Sofritti en collega’s een controversiële muizenstudie gepubliceerd die destijds veel media-aandacht heeft gekregen [9]. Daarin zou zijn aangetoond dat levenslang gebruik van sucralose het risico op lymfomen en leukemie bij mannetjesmuizen verhoogde. Resultaten uit dierstudies zijn interessant als het om het risico op kanker gaat. Ze leveren namelijk sterker bewijs dan in vitro-onderzoek. De European Food and Safety Authority (EFSA) heeft dan ook kritisch naar de studie gekeken [10]. Ze concludeerde dat de studie teveel tekortkomingen kende en daardoor geen aanleiding gaf om de adviezen voor sucralose aan te passen. De belangrijkste tekortkomingen waren:
Desondanks hebben de auteurs van deze studie de Soffritti-studie aangehaald, zonder de tekortkomingen ervan te bespreken, om mee aan te tonen dan sucralose onveilig is. |
2016
In 2016 is er specifiek naar sucralose gekeken [14]. De auteurs (Berry, C. et al.) concluderen dat de studieresultaten geen bewijs leveren dat sucralose genotoxisch is of kanker veroorzaakt. Dit zou in overeenstemming zijn met de chemische structuur en het metabolisme van sucralose.
“In summary, review of the evidence retrieved, including key studies recommended by international regulatory bodies and toxicology experts, confirm that sucralose is noncarcinogenic and safe to ingest. Sucralose does not demonstrate carcinogenic activity even when exposure levels are several orders of magnitude greater than the range of anticipated daily ingestion levels.”
2017
In 2017 is er een review verschenen waarin over een breed gebied naar de veiligheid van sucralose is gekeken [15]. Ook het risico op kanker is erin meegenomen. De auteurs (Magnuson, B.A. et al.) concludeerden dat de betere studies niet laten zien dat sucralose het risico op kanker verhoogt.
“Therefore the credible science and overall weight of evidence confirms the lack of carcinogenic potential of sucralose.”
2020
In 2020 is er gekeken naar mechanistische gegevens van sucralose die tot kanker zouden kunnen leiden [16]. De auteurs (Chappell, G.A. et al.) concludeerden dat er een gebrek aan bewijs is dat sucralose kanker veroorzaakt.
“The results of this systematic and structured assessment of mechanistic data, using categorization and evaluation according to KCCs, complement other assessments from authoritative bodies in concluding that sucralose is safe for its intended use and without concern for mutagenicity and carcinogenicity. These findings are also in agreement with recent comprehensive reviews, which have similarly reported that sucralose is not carcinogenic.”
2021
In 2021 is er gekeken naar het effect van vijf zoetstoffen op de genotoxiciteit, waaronder sucralose [17]. De auteurs (Lea, I.A. et al.) concludeerden dat recente studies niet laten zien dat sucralose genotoxisch is.
“In summary, recent publications do not provide evidence that would justify a change to the SCF and US FDA conclusions that sucralose lacks genotoxic potential.”
2023
In 2023 is er gekeken naar alle zoetstoffen en het risico op kanker [18]. Ook hier concludeerden de auteurs (Pavanello, S. et al.) dat de studies geen bewijs leveren dat sucralose genotoxisch is en kanker veroorzaakt. Er zou dan ook geen aanleiding zijn om de adviezen over sucralose aan te passen.
“In conclusion, there is no evidence of genotoxicity and carcinogenicity of sucralose.”
Sucralose en darmdoorlaatbaarheid
Er is weinig onderzoek gedaan naar het effect van sucralose op de darmdoorlaatbaarheid. In een in vitro-studie is met een vergelijkbare test ook gevonden dat sucralose bij 0,1 mM tot een hogere darmdoorlaatbaarheid leidde [19]. In een studie met muizen waarin darmontstekingen zijn opgewekt zijn echter andere resultaten gevonden [20]. Alle muizen (n=50) kregen eerst gedurende een week een controle-voeding waarna ze gedurende drie weken in vijf groepen werden verdeeld:
- DSS + sacharine (5 mg/kg/dag; 100% ADI)
- DSS + stevia (4 mg/kg/dag; 100% ADI)
- DSS + sucralose (15 mg/kg/dag; 100% ADI)
- Controle
- DSS
DSS staat voor ‘dextran sodium sulfate’, een stof die darmontstekingen (colitis) veroorzaakt. Deze stof wordt vaak gebruikt om colitis (en de behandeling ervan) in knaagdieren te bestuderen. Op verschillende manieren is er naar de darmwand gekeken. Zowel onder een microscoop als naar de genexpressie van eiwitten die betrokken zijn bij de doorlaatbaarheid van de darmwand (claudine-1, occludine, MUC-2, ZO-1, E-cadherin). Denk daarbij aan het bij elkaar houden van aangrenzende cellen (tight junction) waardoor de darmbarrière intact blijft. Alle zoetstoffen lieten een gunstig effect zien vergeleken met alleen DSS. De symptomen van colitis verminderden, darmontstekingen verminderden en de darmwand bood meer bescherming [20]. Een negatief effect op de glucosetolerantie werd niet gevonden.
Wat betekent het concreet voor het gebruik van sucralose?
De resultaten uit de acht experimenten van deze studie vormen geen aanleiding voor gezondheidsinstanties om de adviezen over sucralose aan te passen. Dat wil zeggen dat sucralose tot de ADI van 15 mg/kg lichaamsgewicht per dag veilig te gebruiken is.
Referenties
- Canada Gazette. 1991. Food and drug regulations, amend-ment [Sucralose] (SOR/91-527). Canada Gazette II 125 (20):3125–30.
- European Union (EU). 2004. Directive 2003/115/EC of the European Parliament and of the Council of 22 December 2003 amending Directive 94/35/EC on sweeteners for use in foodstuffs. Off. J. Eur. Union 47 (L24):65–71.
- Japanese Ministry of Health and Welfare (JMHW). 1999. Approval of new high-intensity Sweetener: Sucralose: Revision of the enforcement regulations under the food sanitation law and of the standards and specifications for food and food additives, etc.(published in Official Gazette, No. 2678, July 30, 1999). Japanese Ministry of Health and Welfare (JMHW), Ministry of Health and Welfare Ordinance No.75 (Ministerial Ordinance to Revise Part of the Enforcement regulations under the Food Sanitation Law) and Ministry of Health and Welfare Announcement No. 167.
- United States Food and Drug Administration (US FDA). 1998. Food additives permitted for direct addition to food for human consumption; sucralose. 21CFR Part 172 [Docket No. 87F-0086]. Fed. Regist. 63 (64):16417–33.
- Scientific Committee on Food (SCF). 2000. Opinion of the scientific committee on food on sucralose (Adopted by the SCF on 7 September 2000). European Commission Health & Consumer Protection Directorate-General Directorate C – Scientific Opinions C3 – Management of scientific com-mittees II; scientific co-operation and networks. Scientific Committee on Food [SCF/CS/ADDS/EDUL/190 Final 12/ 9/2000].
- Werness S, Schiffman SS. 2020. Comparison of chromato-graphic results from sucralose-6-acetate (synthesized by Jiangyin PharmaAdvance, Inc., P. R. China) with chromato-graphic and mass spectrometry data from Bornemann et al. 2018.
- Bornemann V, Werness SC, Buslinger L, Schiffman SS. Intestinal Metabolism and Bioaccumulation of Sucralose In Adipose Tissue In The Rat. J Toxicol Environ Health A. 2018;81(18):913-923.
- Richtlijn 2003/115/EG
- Sofritti M, Padovani M, Tibaldi E, et al. Sucralose administered in feed, beginning prenatally through lifespan, induces hematopoietic neoplasias in male swiss mice. Int J Occup Environ Health. 2016;22(1):7-17.
- EFSA ANS Panel (EFSA Panel on Food Additives and Nutrient Sources added toFood), Aguilar F, Crebelli R, Di Domenico A, Dusemund B, Frutos MJ, Galtier P, Gott D, Gundert-Remy U, Lambre C, Leblanc J-C, Lindtner O, Moldeus P, Mosesso P, Parent-Massin D, Oskarsson A, Stankovic I, Waalkens-Berendsen I, Woutersen RA, Wright M, Younes M, Ciccolallo L, Colombo P, Lodi F and Mortensen A, 2017. Statement on the validity of the conclusions of a mouse carcinogenicity study on sucralose (E 955) performed by the Ramazzini Institute. EFSA Journal 2017;15(5):4784, 14 pp.
- OECD/OCDE 451. OECD guideline for the testing of chemicals: carcinogenicity studies. 25 juni 2018.
- Mann SW, Yuschak MM, Amyes SJ, Aughton P, Finn JP. A combined chronic toxicity/carcinogenicity study of sucralose in Sprague-Dawley rats. Food Chem Toxicol. 2000;38 Suppl 2:S71-S89.
- Mann SW, Yuschak MM, Amyes SJ, Aughton P, Finn JP. A carcinogenicity study of sucralose in the CD-1 mouse. Food Chem Toxicol. 2000;38 Suppl 2:S91-S97.
- Berry C, Brusick D, Cohen SM, Hardisty JF, Grotz VL, Williams GM. Sucralose Non-Carcinogenicity: A Review of the Scientific and Regulatory Rationale. Nutr Cancer. 2016 Nov-Dec;68(8):1247-1261.
- Magnuson BA, Roberts A, Nestmann ER. Critical review of the current literature on the safety of sucralose. Food Chem Toxicol. 2017;106(Pt A):324-355.
- Chappell GA, Borghoff SJ, Pham LL, Doepker CL, Wikoff DS. Lack of potential carcinogenicity for sucralose - Systematic evaluation and integration of mechanistic data into the totality of the evidence. Food Chem Toxicol. 2020;135:110898.
- Lea IA, Chappell GA, Wikoff DS. Overall lack of genotoxic activity among five common low- and no-calorie sweeteners: A contemporary review of the collective evidence. Mutat Res Genet Toxicol Environ Mutagen. 2021;868-869:503389.
- Pavanello S, Moretto A, La Vecchia C, Alicandro G. Non-sugar sweeteners and cancer: Toxicological and epidemiological evidence. Regul Toxicol Pharmacol. 2023;139:105369.
- Shil A, Olusanya O, Ghufoor Z, Forson B, Marks J, Chichger H. Artificial Sweeteners Disrupt Tight Junctions and Barrier Function in the Intestinal Epithelium through Activation of the Sweet Taste Receptor, T1R3. Nutrients. 2020;12(6):1862. Published 2020 Jun 22.
- Zhang X, Gu J, Zhao C, et al. Sweeteners Maintain Epithelial Barrier Function Through the miR-15b/RECK/MMP-9 Axis, Remodel Microbial Homeostasis, and Attenuate Dextran Sodium Sulfate-Induced Colitis in Mice. J Agric Food Chem. 2022;70(1):171-183.
Lees publicatie op
https://pubmed.ncbi.nlm.nih.gov/37246822/